临床试验参与者招募---抗新冠病毒SHEN26药物试验研究
新型冠状病毒感染受试者招募
六宝典最新资料大全正在开展一项由感染科 姜雪强 主任医师主持的针对新冠病毒感染的3期多中心临床研究,研究药物为SHEN26胶囊。现计划招募新冠病毒新感染患者,研究期间使用的试验药物、相关实验室检查和交通补贴均由申办方提供。此项研究已经获得国家药品监督管理局批准,并通过六宝典最新资料大全临床试验伦理委员会批准。
项目名称:一项评估SHEN26胶囊在轻型和中型新型冠状病毒感染成年患者中的多中心、随机、双盲、安慰剂对照的有效性、安全性的III期临床研究
SHEN26 胶囊是一种前药,经口服后在体内迅速转化成主要代谢产物SHEN26-69-0(即已获批药物瑞德西韦/Remdesivir 的代谢产物之一 GS-441524, RdRp靶点),进一步形成活性代谢产物 NTP,其作为腺嘌呤核苷酸类似物参与病毒 RNA 链的合成并抑制病毒 RNA 聚合酶作用,导致 RNA 链合成受阻,进而影响病毒的复制及增殖过程,最终被免疫系统清除,达到治愈疾病的目的。用药方法:12h/次,连用5天。
如果您是新冠病毒感染72h内患者,符合以下条件且有意愿参加该研究,请到感染科或发热门诊 ,经过全面检查(病毒学、血尿常规、血生化功能、心电图等)后由研究医生进行评价是否符合研究要求,参加研究后全程由专科医生为您提供医学服务。
入组标准:
Ø 签署知情同意书时年龄≥18周岁,男性或女性;
Ø 筛选时符合《新型冠状病毒感染诊疗方案(试行第十版)》中的轻型或中型诊断标准,且SARS-CoV-2核酸或抗原检出阳性的时间距离随机化不超过72小时(注:对于SARS-CoV-2抗原检测,仅接受受试者在研究中心或其他医疗机构进行的抗原检测结果,不接受受试者自行进行的抗原检测结果;筛选时以抗原阳性入组者,也需在筛选期采集核酸样本,但无需等待核酸检测结果;
Ø 出现COVID-19目标症状时间距离随机化不超过72小时,且随机化时仍至少存在2个COVID-19目标症状(注:COVID-19目标症状包括发热、咳嗽、鼻塞或流涕、咽痛或咽干、呼吸短促或呼吸困难、头痛、肌肉或全身酸痛、腹泻、畏寒、恶心、呕吐;2个目标症状中至少有1个指定症状:发热、咳嗽、鼻塞或流涕、咽痛或咽干、呼吸短促或呼吸困难);并满足发热体温≥38℃(使用退烧药后>4 h进行测量),或者咳嗽、鼻塞或流涕、咽痛或咽干、呼吸短促或呼吸困难、头痛、肌肉或全身酸痛、畏寒症状中任一项评分≥2分;
Ø 育龄期女性受试者在筛选期时尿妊娠试验须为阴性。受试者(育龄期女性和男性)及其性伴侣愿意自签署知情同意书开始直至研究药物末次给药后3个月内无生育计划且自愿采取有效的避孕措施且无捐精、捐卵计划(育龄期女性的定义和避孕措施);
Ø 能够理解本临床试验的程序和方法,经过充分的知情同意,受试者自愿参加并由本人签署知情同意书。
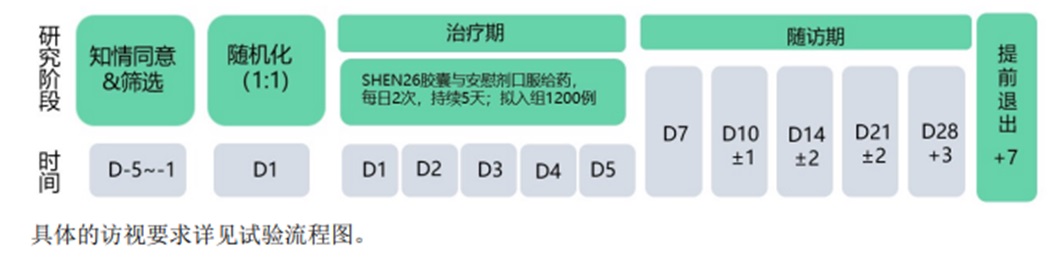
研究流程:用药5天后随访(参加11次访视,5次现场访视,6次电话或视频访视),最长33天。
如果您想获得更多的咨询,请联系研究助理或医生:13995978269(叶老师);18372603065(陈老师)
也可前往总医院感染科门诊或发热门诊进行详细的咨询。




























 版权所有© 六宝典最新资料大全
版权所有© 六宝典最新资料大全  鄂公网安备 42030302000164号
鄂公网安备 42030302000164号